Articles

Dernières recommandations de l’ANSM sur le nom et le conditionnement des médicaments : des mesures bénéfiques
Les dernières recommandations de l’ANSM relatives au nom et au conditionnement des médicaments : des mesures bénéfiques
Au mois de février 2018, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a publié deux recommandations à l’attention des demandeurs d’Autorisations de Mise sur le Marché (AMM).
L’une concerne les noms des médicaments[1] et l’autre l’étiquetage des conditionnements des médicaments sous forme orale solide (hors homéopathie) [2].
Juridiquement, suivre ces recommandations n’est pas obligatoire. Toutefois, en pratique, compte tenu du rôle prépondérant de l’ANSM dans le processus d’approbation et de contrôle de la commercialisation des produits pharmaceutiques, une attention particulière doit être portée à leur contenu (leur non-respect pouvant notamment aboutir au rejet d’une demande d’AMM).
Guidées en particulier par la volonté d’assurer la sécurité du public, notamment en évitant au consommateur tout risque de confusion, les recommandations de l’ANSM aboutissent à limiter la liberté des industriels dans le choix des noms des médicaments, allant jusqu’à interdire le recours aux marques ombrelles (I) et à encadrer strictement l’étiquetage (y compris l’emballage) de tous les produits pharmaceutiques (II).
Parallèlement, l’Association française de l'industrie pharmaceutique pour une automédication responsable (AFIPA), considérant ces mesures comme excessives et instaurant un paquet neutre[3], a formé à leur encontre, par la voie des référés, un recours en annulation devant le Conseil d’Etat.
Si ce recours a été rejeté (principalement au motif que l’AFIPA n’apportait pas suffisamment la preuve de ses prétentions et de l’urgence devant justifier le référé), se pose néanmoins la question du caractère excessif des mesures prises par l’ANSM et de savoir si elles sont propres à assurer les objectifs recherchés. En effet, bien que les recommandations de l’ANSM puissent apparaître légitimes, leur mise en œuvre est susceptible d’aller à l’encontre de l’objectif de sécurité recherché (III).
I - L’interdiction des marques ombrelles
A) Des justifications diverses
Le droit ne définit pas la notion de marque ombrelle.
Il s’agit d’une technique de marketing consistant à identifier sous un même signe ou des signes ayant une racine commune, des produits et / ou des services hétérogènes.
Utilisée dans le domaine pharmaceutique, cette technique conduit à l’utilisation de plusieurs marques identiques ou très proches pour identifier des médicaments différents pouvant avoir des buts thérapeutiques différents ou ne pas contenir les mêmes molécules.
Depuis plusieurs années, cette pratique est notamment critiquée aux motifs qu’elle :
- est susceptible d’induire le patient en erreur[4],
- ferait courir un risque de surdosage en cas de prise de deux médicaments dont les indications thérapeutiques sont différentes mais qui contiennent la même substance active,
- est source de risque de confusion (car les boîtes de produits appartenant à des gammes ombrelles se ressembleraient) et conduirait à une banalisation des médicaments (en raison des graphismes considérés comme trop attractifs, figurant sur les emballages)[5].
B) La portée de l’interdiction
Les recommandations de l’ANSM interdisent le recours aux marques ombrelles dans plusieurs situations :
- d’une manière générale, pour identifier un médicament soumis à prescription médicale obligatoire et un médicament de prescription médicale facultative,
- pour identifier plusieurs médicaments uniquement de prescription médicale facultative dont les AMM sont détenues par le même titulaire, ayant une composition en substances actives différente et des indications thérapeutiques diverses,
- pour identifier à la fois des médicaments (qu’ils soient soumis ou non soumis à prescription médicale obligatoire) et des produits d’autres statuts à finalité sanitaire (tels que des dispositifs médicaux, des produits cosmétiques ou des compléments alimentaires).
Une lecture des textes a contrario pourrait conduire à penser que le recours aux marques ombrelles demeurait possible pour identifier :
- plusieurs médicaments de prescription médicale facultative dont les substances actives sont les mêmes, et qui répondent à des indications thérapeutiques différentes,
- plusieurs médicaments soumis à prescription obligatoire, à tout le moins lorsqu’ils ont la même substance active. D’ailleurs, dans les règles générales concernant les noms de fantaisie de tous les médicaments, la recommandation de l’ANSM précise qu’ « un même nom de fantaisie ou la partie d'un nom de fantaisie assez évocatrice, sur lequel le demandeur s'appuie pour bénéficier de la notoriété d'une spécialité déjà sur le marché, ne peut être utilisé que pour des spécialités ayant le même titulaire et la même composition qualitative en substances actives.», sans viser l’indication thérapeutique.
Toutefois, une telle interprétation des textes se heurte aux buts poursuivis par les textes (empêcher tout risque de confusion, ainsi que de surdosage d’une même substance active), de sorte qu’il est peu probable que l’ANSM fasse une telle lecture de ses recommandations, surtout lorsqu’il s’agit de médicaments vendus sans prescription médicale.
II - Les recommandations encadrant le choix du nom des médicaments et leur emballage
Les mesures prises visent à diminuer l’attractivité des produits (A) et à empêcher tout risque de confusion entre les médicaments (B).
A) Diminuer l’attractivité des produits
Tout d’abord, les marques ne doivent pas véhiculer de message
Les recommandations s’avèrent particulièrement limitatives dans le choix du signe d’une marque.
En effet, le nom doit de préférence être constitué d’un seul mot lorsqu’il consiste en un terme de fantaisie.
De plus, certains signes ou noms ne peuvent pas constituer une marque de médicament ou être inclus dedans. Tel est le cas de ceux :
- pouvant conduire à une banalisation du médicament (notamment en faisant croire aux consommateurs que le produit ainsi dénommé ne constitue pas un médicament),
- qui véhiculent des messages promotionnels au regard des propriétés thérapeutiques et/ou pharmaceutiques ou de la composition du médicament (par exemple FOR(T), FAIBLE, PLUS, MOINS, ULTRA, VITE, HYPER, VITAL, STOP, ANTI, BIO, STRONG, NEW, etc.).
Ensuite, les emballages doivent favoriser l’information médicale du consommateur
Les recommandations de l’ANSM listent minutieusement l’ensemble des informations (parfois nombreuses) devant figurer sur chacune des faces des emballages (qu’il s’agisse des boîtes ou des blisters).
De plus, elles guident également les industriels dans la manière de présenter ces informations.
Ainsi, le choix des couleurs d’un emballage doit être réalisé pour faciliter la lisibilité des mentions et les fabricants sont invités à prendre en compte les anomalies de vision (de sorte que pour protéger les patients daltoniens, un même emballage ne doit pas comporter à la fois les couleurs verte et rouge).
Dans le même esprit, les éléments graphiques et les couleurs d’un emballage ne doivent pas être des instruments marketing mais doivent être mis au service de la lisibilité.
Ainsi, les visuels d’objets de la vie courante, d’images de personnages, de jouets, ou de plantes (même si un des composants est d’origine végétale) ne doivent pas être apposés sur l’emballage, afin de ne pas induire le consommateur en erreur sur la nature du médicament par rapport à d’autres produits, telles que les confiseries.
Les éléments relatifs à l’arôme des médicaments sont également au cœur des recommandations.
En effet, certaines pratiques commerciales consistant à mettre en avant des arômes « tape à l’œil » ou poursuivant un but purement marketing, tels que citron-punch[6] ou capuccino[7], avaient été considérées comme abusives par une partie du corps médical.
Désormais, l’ANSM indique n’accepter qu’au cas par cas la mention de l’arôme dans le nom du médicament (notamment en vue d’assurer une meilleurs observance du traitement).
Et l’apposition sur l’emballage d’un dessin ou d’un fruit reflétant l’arôme du médicament se trouve « proscrite » (sic) dans la mesure où elle n’est pas utile au bon usage du médicament et peut être attractive et source d’intoxication pour les enfants.
B) Mesures présentées comme visant à empêcher tout risque de confusion
Le risque de confusion est entendu très largement pour l’ANSM et il n’a pas la même portée que celle que lui donne le droit des marques.
En droit des marques, le risque de confusion consiste en la possibilité que le public attribue la même origine économique à des produits et/ou à des services.
Pour l’ANSM, le seul fait que deux médicaments puissent être confondus constitue un risque de confusion, peu importe qu’ils émanent de la même entreprise ou d’entreprises économiquement liées.
C’est d’ailleurs cette conception du risque de confusion qui a conduit à l’interdiction des marques ombrelles.
Par ailleurs, considérant que c’est surtout la dénomination commune (le nom scientifique de la substance active constituant les médicaments) qui permet l’identification d’un médicament, l’ANSM recommande qu’elle soit mise en exergue sur les emballages.
Concrètement, elle doit être inscrite dans le premier champ de lecture, en haut à gauche de chaque face des emballages, et ce à l’aide de la taille de police la plus importante.
Corrélativement, l’ANSM recommande que la marque de fantaisie apparaisse au-dessus de la dénomination commune (ou à côté, s’il s’agit du nom du laboratoire) mais en des caractères de taille plus réduite.
Enfin, au motif que le logo ou la marque du laboratoire (sauf si le nom du médicament est constitué de la dénomination commune suivie du nom de l’entreprise l’exploitant) « ne constituent pas une information utile au bon usage du médicament, il est recommandé de ne pas le faire figurer sur la face principale » des emballages.
III - Des mesures légitimes mais pouvant être contreproductives
C’est bien sûr la volonté légitime de préserver la santé du patient qui est au cœur des préoccupations de l’ANSM.
Il est probable qu’interdire les marques ombrelles répondra à l’objectif d’éviter de confondre des médicaments, confusion pouvant entraîner de dangereux surdosages ou interactions médicales.
En effet, l’utilisation d’un même signe distinctif, mis très nettement en exergue, pour des produits répondant à des usages thérapeutiques différents et/ou dont la composition peut varier, peut être source d’incompréhension par le patient.
Toutefois, en allant au-delà de la lutte contre cette pratique spécifique, l’ANSM a émis des recommandations s’appliquant de manière générale à tous les produits pharmaceutiques et qui en voulant offrir aux patients une information complète et immédiate, sont susceptibles de s’avérer contreproductives.
En effet, malgré leur nombre et leur degré de précision, les recommandations de l’ANSM s’avèrent laisser place à une importante part d’interprétation.
Ainsi, l’AFIPA a estimé que la mise en œuvre de ces mesures aboutirait aux résultats suivants[8] :

Force est de constater que les mesures prises pour assurer l’information du patient, conduisent paradoxalement à une perte de lisibilité et de caractère compréhensible des emballages.
D’ailleurs, selon les recommandations de l’ANSM, la face avant d’un emballage peut compter plus de 10 mentions (!).
Compte tenu de leur nombre élevé et du caractère technique de certaines d’entre elles (outre que sauf à augmenter la taille des emballages, elles seront représentées en petits caractères) il est peu probable que le patient les lise et les comprenne toutes.
De plus, l’homogénéisation des emballages engendre des ressemblances, lesquelles peuvent être source de confusion, d’autant que la marque, signe distinctif s’il en est, se trouve reléguée au second plan.
Notons toutefois qu’à la suite des critiques émises par l’AFIPA et du recours en annulation engagé par cette dernière, l’ANSM a publié un communiqué de presse[9] contenant des simulations d’emballages selon ses recommandations et aboutissant à des packagings nettement plus lisibles que ceux ci-dessus :
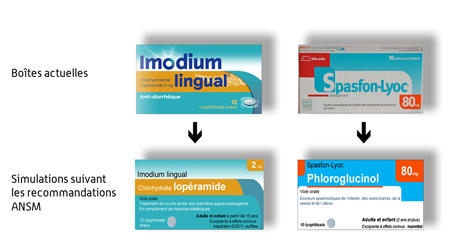
Espérons que l’administration interprétera ses recommandations de la sorte.
Cependant, reste le fait que la généralisation de la règle visant à mettre en avant la dénomination commune des médicaments au détriment des éléments auxquels les consommateurs ont l’habitude de se référer pour identifier des produits (en particulier leur marque, le nom du fabricant, les éléments illustrant l’emballage) risque de s’avérer pour le moins perturbante.
En effet, le patient n’est pas le docteur en pharmacie pour lequel la lecture d’une dénomination commune est immédiatement compréhensible.
Pour reprendre un des exemples figurant dans le communiqué de presse de l’ANSM, il est plus « parlant » pour le patient normalement informé et attentif d’utiliser la marque SPASFON ou SPASFON-LYOC plutôt que la dénomination commune à peine prononçable et encore moins mémorisable PHLOROGLUCINOL.
La marque et le design, et pour autant bien sûr que leur usage ne tombe pas dans certains excès qui ont conduit à l’élaboration des recommandations de l’ANSM, restent les outils les plus sûrs et les plus appropriés pour permettre au consommateur de se repérer, de choisir et de différencier des produits en toute connaissance de cause.
D’ailleurs, l’importance du rôle de la marque comme facteur d’identification des médicaments se trouve reconnue par l’ANSM. Et l’AFIPA avait déjà proposé d’assurer la bonne lisibilité des dénominations communes, plutôt que de diminuer la taille de la marque.
En conséquence, un assouplissement des recommandations guidant l’étiquetage des conditionnements des médicaments permettant l’usage de signes distinctifs plus perceptibles (indépendamment de la taille des autres mentions) pourrait ainsi pleinement assurer l’objectif recherché par l’ANSM d’empêcher tout risque de confusion.
[1] Noms des médicaments : Recommandations à l’attention des demandeurs et titulaires d’autorisations de mise sur le marché et d’enregistrements - Recommandations (22/02/2018)
[2] Etiquetage des conditionnements des médicaments sous forme orale solide (hors homéopathie) - Recommandations à l’attention des demandeurs et titulaires d’autorisations de mise sur le marché et d’enregistrements (28/02/2018)
[3] Recommandations de l'Ansm sur l'étiquetage des médicaments : vers un paquet neutre pour le médicament?
[4] Selon un sondage réalisé par l’ANSM, 38 % des Français pensent que des médicaments portant le même nom contiennent la même substance active (« Pourquoi l'aspect des boîtes de médicaments sans ordonnance fait polémique ? »)
[5] "Gammes ombrelles : une réévaluation sur le fond s'impose à l'ANSM" Rev Prescrire 2015 ; 35 (376) : 139. (pdf, accès libre)
[6] Gammes ombrelles : une réévaluation sur le fond s’impose à l’ANSM
[7] Médicaments aromatises : Michèle Delaunay s’alarme
[8] Recommandations de l'Ansm sur l'étiquetage des médicaments : vers un paquet neutre pour le médicament?
[9] Recommandations relatives aux noms et à l’étiquetage des médicaments : l’ANSM ne demande pas un "paquet neutre" - Communiqué